Axit Nitric - HN03 được biết như một tính axit và oxy hóa cực mạnh. Những ứng dụng của HNO3? Quy trình sản xuất HNO3 trong thực tế như thế nào?… Trong bài viết cụ thể dưới đây, hãy cùng Hà Phan tìm hiểu HNO3 là gì nhé…
Axit nitric và những điều bạn cần biết
1. Tìm hiểu HNO3 (Axit nitric) là gì?
Axit nitric là một hợp chất vô cơ có công thức hóa học HNO3. Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
Axit nitric là một chất axit độc và ăn mòn có thể dễ gây cháy. Acid nitric tinh khiết không màu sắc còn nếu để lâu sẽ có màu hơi vàng do sự tích tụ của các oxit nitơ. Nếu một dung dịch có hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Acid nitric bốc khói có đặc trưng axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào số lượng điôxít nitơ hiện diện.
>>>Có thể bạn sẽ quan tâm: http://www.haphansci.com/tin-tuc/tim-hieu-ve-hoa-chat-barium-chloride/45
2. Tính lý hóa của Axit Nitric
2.1 Tính chất vật lý của Axit Nitric
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, D=1,53g/cm3, sôi ở 860 độ C. Axit nitric tinh khiết kém bền, ngay ở điều kiện thường khi có ánh sáng bị phân hủy một phần giải phóng khí nitơ đioxit (NO2). Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
- Axit nitric tan trong nước theo bất kì tỉ lệ nào.
- Trong phòng thí nghiệm thường có loại axit đặc nồng độ 68%, D=1,40g/cm3.
- Là chất lỏng, không màu, tan tốt trong nước (C < 65%).
***Trong điều kiện thường, dung dịch có màu hơi vàng do HNO3 bị phân hủy chậm:
4HNO3 → 4NO2 + 2H2O + O2 → phải đựng dung dịch HNO3 trong bình tối màu.
>>>Có thể bạn sẽ quan tâm: http://www.haphansci.com/tin-tuc/hoa-chat-petroleum-ether-va-nhung-dieu-ban-chua-bi/43
2.2 Tính chất hóa học của Axit Nitric
*HNO3 là một axit mạnh
Làm quỳ tím chuyển thành màu đỏ. Tác dụng với oxit bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + CuO → Cu(NO3)2 + H2O
Tác dụng với bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
Tác dụng với muối (trong muối kim loại đã đạt hóa trị cao nhất) → muối mới + axit mới:
2HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
*HNO3 là chất oxi hóa mạnh
Tác dụng với kim loại: HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit. Thông thường thì dung dịch đặc → NO2, dung dịch loãng → NO; dung dịch axit càng loãng, kim loại càng mạnh thì N bị khử xuống mức càng sâu.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Chú ý: Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+. HNO3 đặc nguội thụ động với Al, Fe, Cr.
Tác dụng với phi kim → NO2 + H2O + oxit của phi kim.
C + 4HNO3 → CO2 + 4NO2 + 2H2O
S + 4HNO3 → SO2 + 4NO2 + 2H2O
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Tác dụng với các chất khử khác (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất...).
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3. Quy trình sản xuất HNO3 (Axit Nitric)
Trong tự nhiên, axit nitric HNO3 được tạo ra từ các cơn mưa lớn có sét, gây nên những trận mưa axit.
3.1 Sản xuất HNO3 trong phòng thí nghiệm
Trong thực tế, muối natri nitrat tinh thể tác dụng với axit sunfuric đặc, chưng cất hỗn hợp này tại nhiệt độ sôi của axit nitric là 83∘C cho đến khi còn lại chất kết tinh màu trắng. Thế nhưng phương pháp này chỉ tạo ra một lượng nhỏ axit.
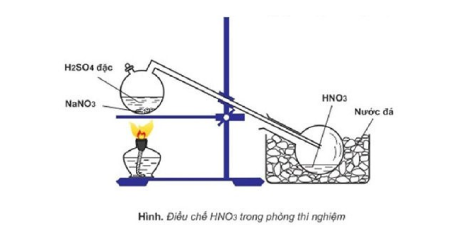
Cách điều chế HN03 trong phòng thí nghiệm
H2SO4d+NaNO3→HNO3+NaHSO4
Axit nitric bốc khói đỏ thu được trong thí nghiệm có thể chuyển thành axit nitric màu trắng. Khi thực hiện thí nghiệm, các dụng cụ cũng cần phải làm từ thủy tinh, đặc biệt là bình cổ cong nguyên khối do axit nitric khan.
3.2 Sản xuất HNO3 trong công nghiệp
Axit nitric loãng có thể cô đặc đến 68% axit với một hỗn hợp azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất với axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3+5O2→4NO+6H2O (Pt, 850∘C)
2NO+O2→NO2
4NO2+O2+2H2O→4HNO3
4. Ứng dụng của Axit Nitric
4.1 Trong phòng thí nghiệm
HNO3 được dùng để làm thuốc thử liên quan tới clorit. Cho HNO3 tác dụng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua. Ngoài ra, nó cũng dùng để điều chế muối nitrat.
4.2 Trong công nghiệp
- Axit nitric HNO2 68% được sử dụng để chế tạo thuốc nổ bao gồm nitroglycerin, trinitrotoluen (TNT) và cyclotrimethylenetrinitramin (RDX), và các loại phân bón chứa nito như phân đạm một lá nitrat amoni NH4NO3, các muối nitrat như KNO3,Ca(NO3)2,…
- Axit nitric có nồng độ 0,5 – 2% thường được sử dụng để làm hợp chất nền nhằm xác định trong dung dịch có tồn tại kim loại không. Người ta gọi đó là kỹ thuật ICP-MS và ICP-AES. Cần dùng HNO3 axit nitric tinh khiết hoàn toàn vì có một số lượng những ion kim loại nhỏ có thể gây ảnh hưởng tới kết quả phân tích.

Ứng dụng của Axit Nitric
- HNO3 phản ứng với hầu hết các kim loại trong các hợp chất hữu cơ nên nó được dụng trong ngành luyện kim, xi mạ và tinh lọc. Khi cho HNO3 này kết hợp với axit clorua, ta được dung dịch nước cường toan có khả năng hòa tan bạch kim và vàng.
- Axit nitric cũng được biết đến là hợp chất trung gian dùng trong sản xuất bọt xốp polyuretan mềm và các sản phẩm polyuretan khác, ví dụ như các chất kết dính, các chất bịt kín, các chất bọc phủ và các chất đàn hồi, đi từ nguyên liệu toluen diisoxyanat.
5. An toàn khi tiếp xúc với Axit Nitric
Axit Nitric có thể phản ứng dữ dội với một số hợp chất như bột kim loại và nhựa thông.
Là chất oxy hóa mạnh gây cháy khi tiếp xúc với vật liệu hữu cơ. Axit Nitric là một axit ăn mòn, có khả năng gây bỏng hóa chất nghiêm trọng.
Hít phải sẽ gặp nguy cơ về sức khỏe bao gồm ăn mòn màng nhầy, phù phổi chậm và thậm chí tử vong. Tiếp xúc với mắt có thể gây tổn thương giác mạc vĩnh viễn.
Khi nuốt phải Acid Nitric sẽ ăn mòn nhanh chóng ở miệng, cổ họng và đường tiêu hóa. Ở nơi làm việc cần có hệ thống thông gió mạnh. Khi tiếp xúc hóa chất cần đeo kính an toàn hóa học, tấm chắn mặt, găng tay và mặt nạ phòng độc.
Lưu trữ Axit Nitric trong một khu vực an toàn khô ráo, thoáng mát. Không bảo quản với các vật liệu không tương thích như hợp chất hữu cơ, kim loại, rượu hoặc độ ẩm.
Tất cả các trường hợp trên đều cần đến cơ sở y tế và phải được bác sĩ trực tiếp chẩn đoán, chăm sóc để có những biện pháp xử lý thích hợp.
6. Đơn vị cung cấp hóa chất Axit Nitric chính hãng
Bạn đang cần mua hóa chất Axit Nitric chất lượng cao nhưng lại có quá nhiều hàng giả, nhái, kém chất lượng trên thị trường?
Công ty Cổ Phần Thương Mại Hà Phan là đơn vị chuyên phân phối hóa chất của các thương hiệu nổi tiếng trên thế giới: Duksan (Hàn Quốc), Xilong (Trung Quốc), Scharlau (Tây Ban Nha),..cùng với đội ngũ nhân viên chuyên nghiệp, có nhiều kinh nghiệm trong lĩnh vực hóa chất.
Tại Hà Phan, chúng tôi có cung cấp dòng sản phẩm hóa chất Axit Nitric chính hãng đến từ thương hiệu Xilong – đơn vị hàng đầu cung cấp hóa chất của Trung Quốc – Hơn nữa, để chúng tôi tự hào là công ty phân phối hóa có cung cấp đầy đủ các chứng từ, chứng nhận về chất lượng và nguồn gốc xuất xứ (CO & CQ) của sản phẩm.
Quý khách có nhu cầu mua sản phẩm hóa chất Axit Nitric vui lòng liên hệ theo hotline: (+84) 28 710 79599 để được đội ngũ tư vấn và nhận báo giá tốt nhất.
---
Liên hệ ngay với Hà Phan để biết thêm thông tin và nhận được chính sách ưu đãi
Tel: (+84) 28 7109 9599
Email: info@haphansci.com
Website: http://haphansci.com

 EN
EN


